Naukowcy z Uniwersytetu w San Jose w Kalifornii postanowili ocenić przydatność sferoidów o czterokrotnie większych rozmiarach, niż standardowe. Do tego celu użyli trójwymiarowego (3D) modelu hodowli komórkowej, metody znacznie bardziej przydatnej fizjologicznie w porównaniu do szeroko stosowanego modelu dwuwymiarowego in vitro.
Sferoidy małych rozmiarów (~500 µm) są powszechnie stosowane w badaniach nad różnorodnymi aktywnościami biologicznymi oraz fizjochemicznymi. Coraz częściej jednak wprowadza się większe modele, które dobrze nadają się do symulacji warunków mikrośrodowiska rozwoju guzów (TME).
Kalifornijski zespół badał w 2020 roku zastosowanie ultra dużych (o rozmiarach nawet 2000 µm!) sferoidów wyhodowanych za pomocą rusztowań biologicznych z użyciem bezdyszowej drukarki 3D o bardzo wysokiej rozdzielczości.
Skafoldy 3D – czym właściwie są?
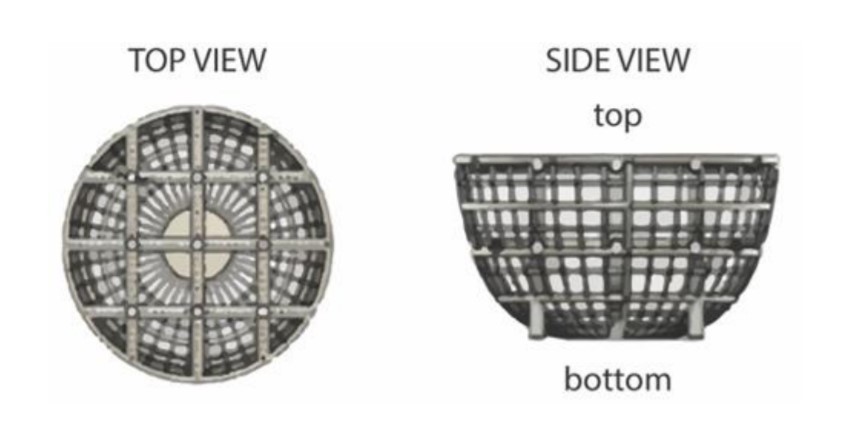
Hodowle komórkowe umieszczane były w specjalnie przygotowanych rusztowaniach (skafoldach) zaprojektowanych i wyprodukowanych przez firmę Prellis Biologics za pomocą bezdyszowej drukarki 3D – Cellink Holograph X.
Skafoldy 3D to biokompatybilne struktury gwarantujące utrzymanie hodowli komórek w jednym miejscu oraz zapewniające im dostęp do tlenu. Zabezpieczona w ten sposób hodowla ma odpowiednie warunki, aby móc się prawidłowo rozwijać.
Przyglądanie się rozwojowi komórek raka piersi
Następnie, naukowcy zajęli się badaniem wpływu używanych w chemioterapii cząsteczkowej doksorubicyny (DOX) oraz jej dwóch pochodnych związków (Dox-NP® oraz DoxovesTM), na wyhodowane duże sferoidy linii komórkowych raka piersi. Eksperyment przeprowadzono na dwóch różnych liniach komórek nowotworowych – MCF-7 oraz MDA-MB-231.
Zespół badaczy badał wpływ ww. leków, w różnych stężeniach dawek, zarówno na duże skafoldy (2000 µm), jak i te o standardowych rozmiarach (500 µm). Ocena wpływu rozmiaru rusztowania na aktywność komórkową w odniesieniu do zastosowanej dawki leku pozwoliła zobrazować atuty oraz ograniczenia ultra dużych skafoldów.
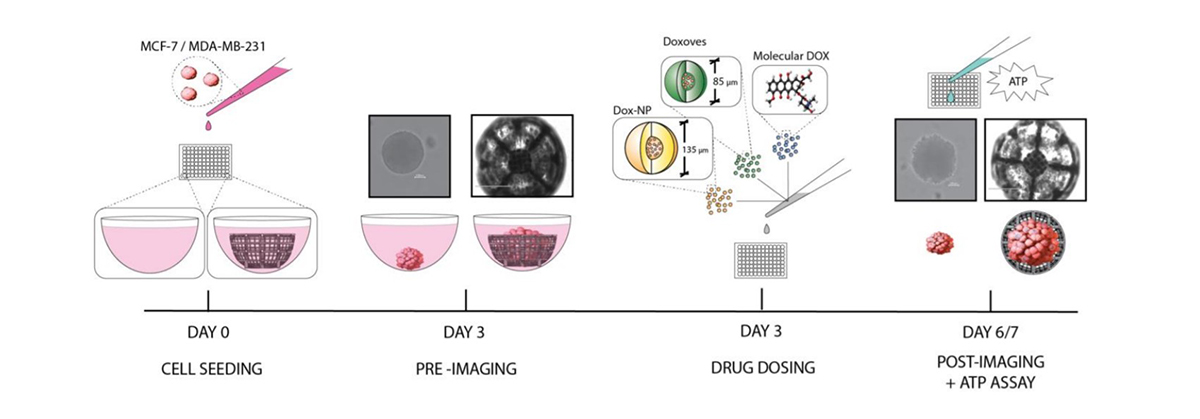
Zespół skupił się na dwóch rozmiarach skafoldów, dla których wykonał badania dla dwóch linii komórek raka piersi (MCF-7 oraz MDA-MB-231); dla trzech leków stosowanych w chemioterapii (DOX, Dox-NP® oraz DoxovesTM) w pięciu stężeniach każdy – 0,05 µM, 0,5 µM, 5 µM i 50 µM oraz dodatkowo dla grupy kontrolnej – bez podawania leku.
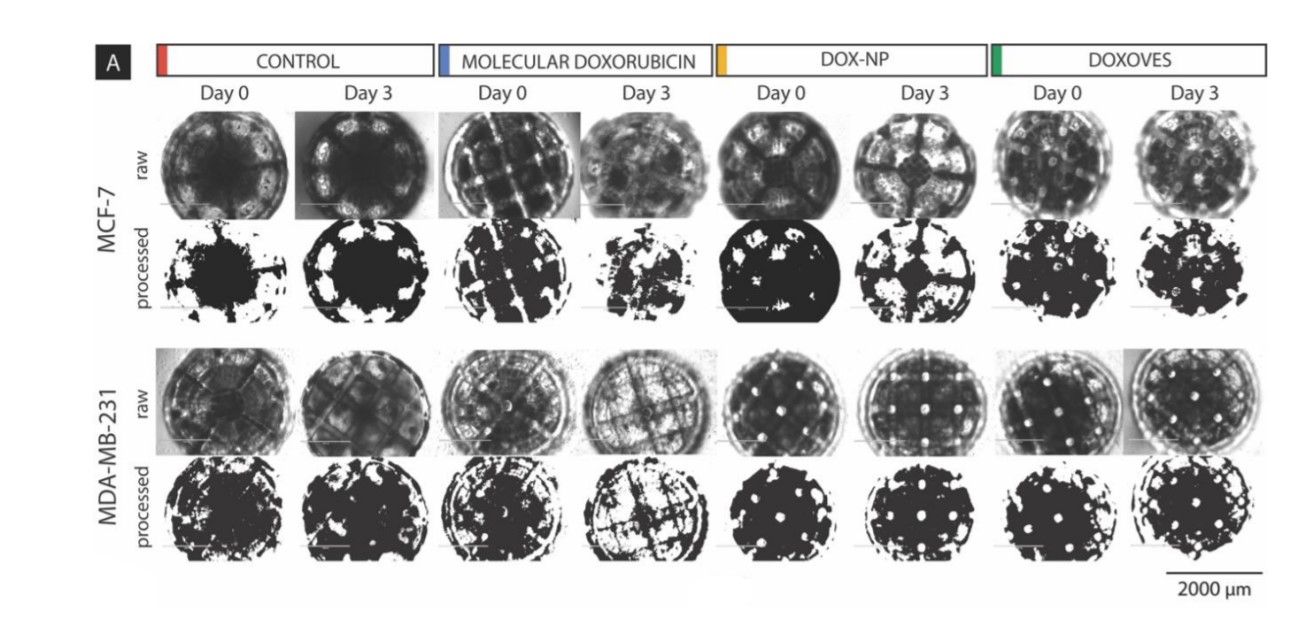
Wyniki pokazały, że największe zahamowanie rozwoju komórek (po 72 godzinach od założenia hodowli) występowało dla cząsteczkowej doksorubicyny DOX, natomiast najniższe dla Dox-NP®.
A zatem… czy rozmiar ma znaczenie?
Badania kalifornijskiego zespołu pokazały, że zarówno sferoidy o małych, jak i dużych rozmiarach, wykazują podobne trendy w rozwoju hodowli. Preparaty z lekami chemioterapeutycznymi podlegają tym samym tendencjom.
Niekwestionowaną zaletą ultra dużych skafoldów jest znaczne skrócenie czasu rozwoju hodowli – niektórym typom komórek wystarczają 24 godziny! Ich duży rozmiar jest przydatny w badaniach nad komórkami, które niełatwo tworzą sferoidy (np. użyte w tym badaniu MDA-MB-231).
Duże rozmiary pozwalają również na całkowite odtworzenie struktury 3D hodowli, dając informację o zagęszczeniu komórek w eksperymencie – właściwość, której brakuje przy użyciu skafoldów o małych rozmiarach. Analiza otrzymanych obrazów mikroskopowych dostarcza wiele informacji potrzebnych do oceny zahamowania rozwoju hodowli pod wpływem podanych dawek leku.
Wady dużych skafoldów skupiają się przede wszystkim wokół ograniczeń technologicznych, a w szczególności ich ceny. Wyprodukowanie tak dużych skafoldów jest bardzo kosztowne, znacznie bardziej niż w przypadku ich 4 lub 5-krotnie mniejszych wersji.
Dodatkowo, stosowanie rusztowań o średnicy 2000 µm wymaga opracowania indywidualnego protokołu badania dla każdego typu komórki, co może nie wydawać się istotne, lecz w rzeczywistości jest kwestią pracochłonną i wymagającą dużo uwagi.
Ponadto, naukowcy zauważyli zależność pomiędzy rozmiarem skafoldów a przenikalnością światła. Im skafold jest większy, tym ciężej jest światłu przedostać się do środka, co zaburza pozyskiwanie obrazów z użyciem barwienia fluorescencyjnego, co z kolei wpływa na jakość pozyskanych danych.
Wprowadzanie nowej metody hodowli komórek rakowych jest podstawą do dalszych badań w celu wykorzystania ultra dużych skafoldów w testach leków wykorzystywanych w walce z nowotworami.
Autor: Marta Robak
Źródło: „Assessing Advantages and Drawbacks of Rapidly Generated Ultra-Large 3D Breast Cancer Spheroids: Studies with Chemotherapeutics and Nanoparticles” International Journal of Molecular Sciences








